a. Sifat gelombang partikel
Di paruh pertama abad 20, mulai diketahui bahwa gelombang elektromagnetik, yang sebelumnya dianggap gelombang murni, berperilaku seperti partikel (foton). Fisikawan Perancis Louis Victor De Broglie (1892-1987) mengasumsikan bahwa sebaliknya mungkin juga benar, yakni materi juga berperilaku seperti gelombang. Berawal dari persamaan Einstein, E = cp dengan p adalah momentum foton, c kecepatan cahaya dan E adalah energi, ia mendapatkan hubungan:
E = hν =ν = c/λ atau hc/ λ = E, maka h/ λ= p … (2.12)
De Broglie menganggap setiap partikel dengan momentum p = mv disertai dengan gelombang (gelombang materi) dengan panjang gelombang λ didefinisikan dalam persamaan (2.12) (1924). Tabel 2.2 memberikan beberapa contoh panjag gelombang materi yang dihitung dengan persamaan (2.12). Dengan meningkatnya ukuran partikel, panjang gelombangnya menjadi lebih pendek. Jadi untuk partikel makroskopik, particles, tidak dimungkinkan mengamati difraksi dan fenomena lain yang berkaitan dengan gelombang. Untuk partikel mikroskopik, seperti elektron, panjang gelombang materi dapat diamati. Faktanya, pola difraksi elektron diamati (1927) dan membuktikan teori De Broglie.
Tabel 2.2 Panjang-gelombang gelombang materi.
| partikel | massa (g) | kecepatan (cm s-1) | Panjang gelombang (nm) |
| elektron (300K) | 9,1×10-28 | 1,2×107 | 6,1 |
| elektron at 1 V | 9,1×10-28 | 5,9×107 | 0,12 |
| elektron at 100 V | 9,1×10-28 | 5,9×108 | 0,12 |
| He atom 300K | 6,6×10-24 | 1,4×105 | 0,071 |
| Xe atom 300K | 2,2×10-22 | 2,4×104 | 0,012 |
Latihan 2.7 Panjang-gelombang gelombang materi.
Peluru bermassa 2 g bergerak dengan kecepatan 3 x 102 m s-1. Hitung panjang gelombang materi yang berkaitan dengan peluru ini.
Jawab: Dengan menggunakan (2.12) dan 1 J = 1 m2 kg s-2, λ = h/ mv = 6,626 x 10-34 (J s)/ [2,0 x 10-3(kg) x 3 x102(m s-1)] = 1,10 x 10-30 (m2 kg s-1)/ (kg m s-1) = 1,10 x 10-30 m
Perhatikan bahwa panjang gelombang materi yang berkaitan dengan gelombang peluru jauh lebih pendek dari gelombang sinar-X atau γ dan dengan demikian tidak teramati.
b. Prinsip ketidakpastian
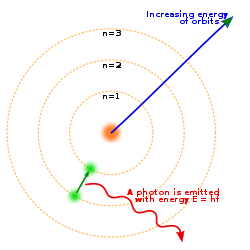
Dari yang telah dipelajari tentang gelombang materi, kita dapat mengamati bahwa kehati-hatian harus diberikan bila teori dunia makroskopik akan diterapkan di dunia mikroskopik. Fisikawan Jerman Werner Karl Heisenberg (1901-1976) menyatakan tidak mungkin menentukan secara akurat posisi dan momentum secara simultan partikel yang sangat kecil semacam elektron. Untuk mengamati partikel, seseorang harus meradiasi partikel dengan cahaya. Tumbukan antara partikel dengan foton akan mengubah posisi dan momentum partikel.
Heisenberg menjelaskan bahwa hasil kali antara ketidakpastian posisi

x dan ketidakpastian momentum

p akan bernilai sekitar konstanta Planck:

x

p = h (2.13)
Hubungan ini disebut dengan prinsip ketidakpastian Heisenberg.
Latihan 2.8 Ketidakpastian posisi elektron.
Anggap anda ingin menentukan posisi elektron sampai nilai sekitar 5 x 10-12 m. Perkirakan ketidakpastian kecepatan pada kondisi ini.
Jawab: Ketidakpastian momentum diperkirakan dengan persamaan (2.13).

p = h/

x = 6,626 x 10
-34 (J s)/5 x 10
-12 (m) = 1,33 x 10
-22 (J s m
-1). Karena massa elektron 9,1065 x 10
-31 kg, ketidakpastian kecepatannya

v akan benilai:

v = 1,33 x 10
-22(J s m
-1) / 9,10938 x 10
-31 (kg) = 1,46 x 10
8 (m s
-1).
Perkiraan ketidakpastian kecepatannya hampir setengah kecepatan cahaya (2,998 x108 m s-1) mengindikasikan bahwa jelas tidak mungkin menentukan dengan tepat posisi elektron. Jadi menggambarkan orbit melingkar untuk elektron jelas tidak mungkin.
c. Persamaan Schrödinger
Fisikawan Austria Erwin Schrödinger (1887-1961) mengusulkan ide bahwa persamaan De Broglie dapat diterapkan tidak hanya untuk gerakan bebas partikel, tetapi juga pada gerakan yang terikat seperti elektron dalam atom. Dengan memperuas ide ini, ia merumuskan sistem mekanika gelombang. Pada saat yang sama Heisenberg mengembangkan sistem mekanika matriks. Kemudian hari kedua sistem ini disatukan dalam mekanika kuantum.
Dalam mekanika kuantum, keadaan sistem dideskripsikan dengan fungsi gelombang. Schrödinger mendasarkan teorinya pada ide bahwa energi total sistem, E dapat diperkirakan dengan menyelesaikan persamaan. Karena persamaan ini memiliki kemiripan dengan persamaan yang mengungkapkan gelombang di fisika klasik, maka persamaan ini disebut dengan persamaan gelombang Schrödinger.
Persamaan gelombang partikel (misalnya elektron) yang bergerak dalam satu arah (misalnya arah x) diberikan oleh:
(-h2/8π2m)(d2Ψ/dx2) + VΨ = EΨ … (2.14)
m adalah massa elektron, V adalah energi potensial sistem sebagai fungsi koordinat, dan Ψ adalah fungsi gelombang.
POTENSIAL KOTAK SATU DIMENSI (SUB BAB INI DI LUAR KONTEKS KULIAH KITA)
Contoh paling sederhana persamaan Schrödinger adalah sistem satu elektron dalam potensial kotak satu dimensi. Misalkan enegi potensial V elektron yang terjebak dalam kotak (panjangnya a
adalah 0 dalam kotak (0 < x < a) dan ∞ di luar kotak. Persamaan Schrödinger di dalam kotak menjadi:
d2Ψ/dx2 = (-8π2mE/h2)Ψ … (2.15)
Ψ= 0 di x = 0 dan x = a … (2.16)
Persamaan berikut akan didapatkan sebagai penyelesaian persamaan-persamaan di atas:
Ψ(x) = (√2/a)sin(nπx/a) … (2.17)
Catat bahwa n muncul secara otomatis. Persamaan gelombang Ψ sendiri tidak memiliki makna fisik. Kuadrat nilai absolut Ψ, Ψ2, merupakan indikasi matematis kebolehjadian menemukan elektron dalam posisi tertentu, dan dengan demikian sangat penting sebab nilai ini berhubungan dengan kerapatan elektron. Bila kebolhejadian menemukan elektron pada posisi tertentu diintegrasikan di seluruh ruang aktif, hasilnya harus bernilai satu, atau secara matematis:
∫Ψ2dx = 1
Energinya (nilai eigennya) adalah
E = n2h2/8ma2; n = 1, 2, 3… (2.18)
Jelas bahwa nilai energi partikel diskontinyu.
|
ATOM MIRIP HIDROGEN
Dimungkinkan uintuk memperluas metoda yang digunakan dalam potensial kotak satu dimensi ini untuk menangani atom hidrogen dan atom mirip hidrogen secara umum. Untuk keperluan ini persamaan satu dimensi (2.14) harus diperluas menjadi persamaan tiga dimensi sebagai berikut:
(-h2/8π2m)Ψï¼»(∂2/∂x2) + (∂2/∂y2) +(∂2/∂z2)ï¼½+V(x, y, z)Ψ = EΨ … (2.19)
Bila didefinisikan ∇2 sebagai:
(∂2/∂x2) + (∂2/∂y2) +(∂2/∂z2) = ∇2 … (2.20)
Maka persamaan Schrödinger tiga dimensi akan menjadi:
(-h2/8π2m)∇2Ψ +VΨ = EΨ … (2.21)
atau ∇2Ψ +(8π 2m/h2)(E -V)Ψ = 0 … (2.22)
Energi potensial atom mirip hidrogen diberikan oleh persamaan berikut dengan Z adalah muatan listrik.
V = -Ze2/4πε0r … (2.23)
Bila anda substitusikan persamaan (2.23) ke persamaan (2.22), anda akan mendapatkan persamaan berikut.
∇2Ψ+(8π2m/h2)ï¼»E + (Ze2/4πε0r)ï¼½Ψ = 0 … (2.24)
Ringkasnya, penyelesaian persamaan ini untuk energi atom mirip hidrogen cocok dengan yang didapatkan dari teori Bohr.
BILANGAN KUANTUM
Karena elektron bergerak dalam tiga dimensi, tiga jenis bilangan kuantum (Bab 2.3(b)), bilangan kuantum utama, azimut, dan magnetik diperlukan untuk mengungkapkan fungsi gelombang. Dalam Tabel 2.3, notasi dan nilai-nilai yang diizinkan untuk masing-masing bilangan kuantum dirangkumkan. Bilangan kuantum ke-empat, bilangan kuantum magnetik spin berkaitan dengan momentum sudut elektron yang disebabkan oleh gerak spinnya yang terkuantisasi. Komponen aksial momentum sudut yang diizinkan hanya dua nilai, +1/2(h/2π) dan -1/2(h/2π). Bilangan kuantum magnetik spin berkaitan dengan nilai ini (ms = +1/2 atau -1/2). Hanya bilangan kuantum spin sajalah yang nilainya tidak bulat.
Tabel 2.3 Bilangan kuantum
| Nama (bilangan kuantum) | simbol | Nilai yang diizinkan |
| Utama | n | 1, 2, 3,… |
| Azimut | l | 0, 1, 2, 3, …n – 1 |
| Magnetik | m(ml) | 0, ±1, ±2,…±l |
| Magnetik spin | ms | +1/2, -1/2 |
Simbol lain seperti yang diberikan di Tabel 2.4 justru yang umumnya digunakan. Energi atom hidroegn atau atom mirip hidrogen ditentukan hanya oleh bilangan kuantum utama dan persamaan yang mengungkapkan energinya identik dengan yang telah diturunkan dari teori Bohr.
Tabel 2.4 Simbol bilangan kuantum azimut
d. Orbital
Fungsi gelombang elektron disebut dengan orbital. Bila bilangan koantum utama n = 1, hanya ada satu nilai l, yakni 0. Dalam kasus ini hanya ada satu orbital, dan kumpulan bilangan kuantum untuk orbital ini adalah (n = 1, l = 0). Bila n = 2, ada dua nilai l, 0 dan 1, yang diizinkan. Dalam kasus ada empat orbital yang didefinisikan oelh kumpulan bilangan kuantum: (n = 2, l = 0), (n = 2, l = 1, m = -1), (n = 2, l = 1, m = 0), (n = 2, l = 1, m = +1).
Latihan 2.9 Jumlah orbital yang mungkin.
Berapa banyak orbital yang mungkin bila n = 3. Tunjukkan kumpulan bilangan kuantumnya sebagaimana yang telah dilakukan di atas.
Jawab: Penghitungan yang sama dimungkinkan untuk kumpulan ini (n = 3, l = 0) dan (n = 3, l = 1). Selain itu, ada lima orbital yang betkaitan dengan (n =3, l =2). Jadi, (n = 3, l = 0), (n = 3, l = 1, m = -1), (n =3, l = 1, m =0), (n =3, l = 1, m = +1) 〠(n =3, l =2, m = -2), (n =3, l = 2, m = -1), (n = 3, l = 2, m = 0), (n = 3, l = 2,m =+1), (n = 3, l = 2, m = +2). Semuanya ada 9 orbital.
Singkatan untuk mendeskripsikan orbita dengan menggunakan bilangan kuantum utama dan simbol yang ada dalam Tabel 2.4 digunakan secara luas. Misalnya orbital dengan kumpulan bilangan kuantum (n = 1, l = 0) ditandai dengan 1s, dan orbital dengan kumpulan bilangan kuantum (n = 2, l = 1) ditandai dengan 2p tidak peduli nilai m-nya.
Sukar untuk mengungkapkan Ψ secara visual karena besaran ini adalah rumus matematis. Namun, Ψ2 menyatakan kebolehjadian menemukan elektron dalam jarak tertentu dari inti. Bila kebolhejadian yang didapatkan diplotkan, anda akan mendapatkan Gambar 2.5. Gambar sferis ini disebut dengan awan elektron.
Bila kita batasi kebolehjadian sehingga katakan kebolehjadian menemukan elektron di dalam batas katakan 95% tingkat kepercayaan, kita dapat kira-kira memvisualisasikan sebagai yang ditunjukkan dalam Gambar 2.6.
KONFIGURASI ELEKTRON ATOM
Bila atom mengnadung lebih dari dua elektron, interaksi antar elektron harus dipertimbangkan, dan sukar untuk menyelesaikan persamaan gelombang dari sistem yang sangat rumit ini. Bila diasumsikan setiap elektron dalam atom poli-elektron akan bergerak dalam medan listrik simetrik yang kira-kira simetrik orbital untuk masing-masing elektron dapat didefinisikan dengan tiga bilangan kuantum n, l dan m serta bilangan kunatum spin ms, seperti dalam kasus atom mirip hidrogen.
Energi atom mirip hidrogen ditentukan hanya oleh bilangan kuantum utama n, tetapi untuk atom poli-elektron terutama ditentukan oleh n dan l. Bila atom memiliki bilangan kuantum n yang sama, semakin besar l, semakin tinggi energinya.
PRINSIP EKSKLUSI PAULI
Menurut prinsip eksklusi Pauli, hanya satu elektron dalam atom yang diizinkan menempati keadaan yang didefinisikan oleh kumpulan tertentu 4 bilangan kuantum, atau, paling banyak dua elektron dapat menempati satu orbital yang didefinisikan oelh tiga bilangan kuantum n, l dan m. Kedua elektron itu harus memiliki nilai ms yang berbeda, dengan kata lain spinnya antiparalel, dan pasangan elektron seperti ini disebut dengan pasangan elektron.
Kelompok elektron dengan nilai n yang sama disebut dengan kulit atau kulit elektron. Notasi yang digunakan untuk kulit elektron diberikan di Tabel 2.5.
Tabel 2.5 Simbol kulit elektron.
Tabel 2.6 merangkumkan jumlah maksimum elektron dalam tiap kulit, mulai kulit K sampai N. Bila atom dalam keadaan paling stabilnya, keadaan dasar, elektron-elektronnya akan menempati orbital dengan energi terendah, mengikuti prinsip Pauli.
Tabel 2.6 Jumlah maksimum elektron yang menempati tiap kulit.
| n | kulit | l | simbol | Jumlah
maks elektron | total di kulit |
| 1 | K | 0 | 1s | 2 | (2 = 2×12) |
| 2 | L | 0 | 2s | 2 | (8 = 2×22) |
| | 1 | 2p | 6 | |
| 3 | M | 0 | 3s | 2 | (18 = 2×32) |
| | 1 | 3p | 6 | |
| | 2 | 3d | 10 | |
| 4 | N | 0 | 4s | 2 | (32 = 2×42) |
| | 1 | 4p | 6 | |
| | 2 | 4d | 10 | |
| | 3 | 4f | 14 | |
Di Gambar 2.7, tingkat energi setiap orbital ditunjukkan. Dengan semakin tingginya energi orbital perbedaan energi antar orbital menjadi lebih kecil, dan kadang urutannya menjadi terbalik. Konfigurasi elektron setiap atom dalam keadaan dasar ditunjukkan dalam Tabel 5.4. Konfigurasi elektron kulit terluar dengan jelas berubah ketika nomor atomnya berubah. Inilah teori dasar hukum periodik, yang akan didiskusikan di Bab 5.
Harus ditambahkan di sini, dengan menggunakan simbol yang diberikan di Tabel 2.6, konfigurasi elektron atom dapat dungkapkan. Misalnya, atom hidrogen dalam keadaan dasar memiliki satu elektron diu kulit K dan konfigurasi elektronnya (1s1). Atom karbon memiliki 2 elektron di kulit K dan 4 elektron di kulit L. Konfigurasi elektronnya adalah (1s22s22p2).