1. Hukum kekekalan massa ( hukum Lavoiser )
Hukum Lavoiser berbunyi :
" Dalam hukum reaksi kimia, jumlah massa zat-zat sebelum dan sesudah reaksi adalah sama"
2. Hukum perbandingan tetap ( hukum Proust )
Hukum Proust berbunyi :
" Perbandingan berat (massa) unsur-unsur yang menyusun suatu senyawa selalu tetap (tidak pernah berubah) "
3. Hukum kelipatan berganda dari Dalton
Hukum Dalton berbunyi :
" Bila dua unsur dapat membentuk dua atau lebih senyawa, maka perbandingan massa unsur yang satu, yang diikat oleh unsur lain yang massanya sama, akan mempunyaiperbandinagn bilangan yang bulat dan sederhana"
Unknown
Perubahan kimia sering disebut reaksi kimia. Zat semula yang berubah disebut pereaksi (reakton), sedangkan zat baru yang terbentuk disebut hasil reaksi (produk).
Salah satu perubahan kimia dalam kehidupan sehari-hari adalah reaksi oksidasi, yaitu reaksi suatu zat dengan gas oksigen.
Reaksi oksidasi yang berlangsung cepat disebut pembakaran, misalnya pembakaran kertas atau mereaksikan kertas dengan gas oksigen di udara menjadi abu. Reaksi oksidasi yang berlangsung lambat disebut perkaratan pada logam atau pelapukan pada kayu.
Ada terdapat empat petunjuk yang menandai berlangsungnya suatu perubahan kimia, yakni :
Salah satu perubahan kimia dalam kehidupan sehari-hari adalah reaksi oksidasi, yaitu reaksi suatu zat dengan gas oksigen.
Reaksi oksidasi yang berlangsung cepat disebut pembakaran, misalnya pembakaran kertas atau mereaksikan kertas dengan gas oksigen di udara menjadi abu. Reaksi oksidasi yang berlangsung lambat disebut perkaratan pada logam atau pelapukan pada kayu.
Ada terdapat empat petunjuk yang menandai berlangsungnya suatu perubahan kimia, yakni :
- pembentukan gas,
- pembentukan endapan,
- perubahan warna,
- perybahan suhu.
Unknown
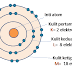
a. Atom
Dalam teori atom satuan terkecil dalam materi adalah atom. Materi itu sendiri adalah kumpulan dari atom. Atom adalah unsur yang tidak akn mengalami perubahan dalam reaksi kimia.
b. Molekul
Molekul adalah satu atau beberapa atom yang berikatan sangat kuat dan memiliki muatan netral. Stu atom dalam molekul disebut monoatonik, sedangkan molekul yang memiliki beberapa atom disebut poliatonik.
c. Ion
Ion adalah satu atau beberapa atom yang memiliki muatan listrik. Ion yang bermuatan positif disebut
Dalam teori atom satuan terkecil dalam materi adalah atom. Materi itu sendiri adalah kumpulan dari atom. Atom adalah unsur yang tidak akn mengalami perubahan dalam reaksi kimia.
b. Molekul
Molekul adalah satu atau beberapa atom yang berikatan sangat kuat dan memiliki muatan netral. Stu atom dalam molekul disebut monoatonik, sedangkan molekul yang memiliki beberapa atom disebut poliatonik.
c. Ion
Ion adalah satu atau beberapa atom yang memiliki muatan listrik. Ion yang bermuatan positif disebut
Unknown
Perubahan materi dapat digolongkan menjadi dua, yaitu sebagai berikut:
- Perubahan fisis, merupakan perubahan wujud yang tidak menghasilkan zat baru.
- Perubahan kimia, merupakan perubahan materi yang mengakibatkan terbentuknya zat baru.
1. CONTOH-CONTOH PERUBAHAN FISIS:
- Perubahan logam nikel. Pada pembakaran nikel, walaupu terbakar membara, logam itu kembali pada keadaan semula.
- Pelarutan garam dapur dalam air.
- Pembakaran kawat nikrom
- Proses terjadinya hujan.
- Pemanasan belerang secara lemah
- Pembakaran logam magnesium. Pada pembakaran pita magnesium, menimbulkan cahaya terang dan menghasilkan abu berwarna putih.
- Pelarutan logam besi dengan asam klorida pekat.
- Pembakaran kertas menjadi abu.
- Proses terjadinya pembusukan.
- Pemanasan belerangsecara kuat.
3.PERUBAHAN FISIS DAN KIMIA DALAM INDUSTRI:
Contoh perubahan fisis dalam industri yakni :
- pengolaha gula pasir dari batang tebu,
- pengolahan bensin dari minyak mentah.
Contoh perubahan kimia dalam industri yakni :
- pengolahan logam alumunium dari biji bauksit,
- peolahan pupuk urea dari gas amoniak.
Unknown
Materi adalah segala sesuatu yang menempati ruang, mempunyai massa, dan mempunyai sifat-sifat yang dapat dirasakan oleh panca indra manusia.
Cabang ilmu pengetahuan alam yang mempelajari struktur materi, sifat-sifat materi, perubahan suatu materi menjadi materi lainnya, serta energi yang menyertainya perubahan materi adalah ilmu kimia. Perubahan suatu materi menjadi materi lain disebut reaksi kimia.
Materi terdapat dalam tiga wujud, yakni : padat, cair, dan gas. Materi dapat juga digolongkan menjadi dua, yakni : zat tunggal dan zat campuran.
Setiap materi mempunyai sifat yang khas yang dapat digolongkan menjadi dua, yaitu sebagai berikut:
- Sifat fisika, yaitu sifat-sifat materi yang behubungan dengan gajala-gejala fisika.
- Sifat kimia, yaitu sifat-sifat materi yang behubungan dengan gejala-gejala kimia.
Unknown
Kimia modern dimulai oleh kimiawan Perancis Antoine Laurent Lavoisier (1743-1794). Ia menemukan hukum kekekalan massa dalam reaksi kimia, dan mengungkap peran oksigen dalam pembakaran. Berdasarkan prinsip ini, kimia maju di arah yang benar.
Sebenarnya oksigen ditemukan secara independen oleh dua kimiawan, kimiawan Inggris Joseph Priestley (1733-1804) dan kimiawan Swedia Carl Wilhelm Scheele (1742-1786), di penghujung abad ke-18. Jadi, hanya sekitar dua ratus tahun sebelum kimia modern lahir. Dengan demikian, kimia merupakan ilmu pengetahuan yang relatif muda bila dibandingkan dengan fisika dan matematika, keduanya telah berkembang beberapa ribu tahun.
Namun alkimia, metalurgi dan farmasi di zaman kuno dapat dianggap sebagai akar kimia. Banyak penemuan yang dijumpai oleh orang-orang yang terlibat aktif di bidang-bidang ini berkontribusi besar pada kimia modern walaupun alkimia didasarkan atas teori yang salah. Lebih lanjut, sebelum abad ke-18, metalurgi dan farmasi sebenarnya didasarkan atas pengalaman saja dan bukan teori. Jadi, nampaknya tidak mungkin titik-titik awal ini yang kemudian berkembang menjadi kimia modern. Berdasarkan hal-hal ini dan sifat kimia modern yang terorganisir baik dan sistematik metodologinya, akar sebenarnya kimia modern mungkin dapat ditemui di filosofi Yunani kuno.
Jalan dari filosofi Yunani kuno ke teori atom modern tidak selalu mulus. Di Yunani kuno, ada perselisihan yang tajam antara teori atom dan penolakan keberadaan atom. Sebenarnya, teori atom tetap tidak ortodoks dalam dunia kimia dan sains. Orang-orang terpelajar tidak tertarik pada teori atom sampai abad ke-18. Di awal abad ke-19, kimiawan Inggris John Dalton (1766-1844) melahirkan ulang teori atom Yunani kuno. Bahkan setelah kelahirannya kembali ini, tidak semua ilmuwan menerima teori atom. Tidak sampai awal abad 20 teori ato, akhirnya dibuktikan sebagai fakta, bukan hanya hipotesis. Hal ini dicapai dengan percobaan yang terampil oleh kimiawan Perancis Jean Baptiste Perrin (1870-1942). Jadi, perlu waktu yang cukup panjang untuk menetapkan dasar kimia modern.
Sebagaimana dicatat sebelumnya, kimia adalah ilmu yang relatif muda. Akibatnya, banyak yang masih harus dikerjakan sebelum kimia dapat mengklaim untuk mempelajari materi, dan melalui pemahaman materi ini memahami alam ini. Jadi, sangat penting di saat awal pembelajaran kimia kita meninjau ulang secara singkat bagaimana kimia berkembang sejak kelahirannya.
a. Teori atom kuno
Sebagaimana disebut tadi, akar kimia modern adalah teori atom yang dikembangkan oleh filsuf Yunani kuno. Filosofi atomik Yunani kuno sering dihubungkan dengan Democritos (kira-kira 460BC- kira-kira 370 BC). Namun, tidak ada tulisan Democritos yang tinggal. Oleh karena itu, sumber kita haruslah puisi panjang “De rerum natura” yang ditulis oleh seniman Romawi Lucretius (kira-kira 96 BC- kira-kira 55 BC).

Atom yang dipaparkan oleh Lucretius memiliki kemiripan dengan molekul modern. Anggur (wine) dan minyak zaitun, misalnya memiliki atom-atom sendiri. Atom adalah entitas abstrak. Atom memiliki bentuk yang khas dengan fungsi yang sesuai dengan bentuknya. ”Atom anggur bulat dan mulus sehingga dapat melewati kerongkongan dengan mulus sementara atom kina kasar dan akan sukar melalui kerongkongan”. Teori struktural modern molekul menyatakan bahwa terdapat hubungan yang sangat dekat antara struktur molekul dan fungsinya.
Walaupun filosofi yang terartikulasi oleh Lucretius tidak didukung oleh bukti yang didapat dari percobaan, inilah awal kimia modern.
Dalam periode yang panjang sejak zaman kuno sampai zaman pertengahan, teori atom tetap In heretikal (berlwanan dengan teori yang umum diterima) sebab teori empat unsur (air, tanah, udara dan api) yang diusulkan filsuf Yunani kuno Aristotole (384 BC-322 BC) menguasi. Ketika otortas Aristotle mulai menurun di awal abad modern, banyak filsuf dan ilmuwan mulai mengembangkan teori yang dipengaruhi teori atom Yunani. Gambaran materi tetap dipegang oleh filsuf Perancis Rene Descartes (1596-1650), filsuf Jerman Gottfried Wilhelm Freiherr von Leibniz (1646-1716), dan ilmuwan Inggris Sir Issac Newton (1642-1727) yang lebih kurang dipengaruhi teori atom.
b. Teori atom Dalton
Di awal abad ke-19, teori atom sebagai filosofi materi telah dikembangkan dengan baik oleh Dalton yang mengembangkan teori atomnya berdasarkan peran atom dalam reaksi kimia. Teori atomnya dirangkumkan sebagai berikut:
Teori atom Dalton:
(i) partikel dasar yang menyusun unsur adalah atom. Semua atom unsur tertentu identik.
(ii) massa atom yang berjenis sama akan identik tetapi berbeda dengan massa atom unsur jenis lain.
(iii) keseluruhan atom terlibat dalam reaksi kimia. Keseluruhan atom akan membentuk senyawa. Jenis dan jumlah atom dalam senyawa tertentu tetap.
Dasar teoritik teori Dalton terutama didasarkan pada hukum kekekalan massa dan hukum perbandingan tetap. Keduanya telah ditemukan sebelumnya, dan hukum perbandingan berganda yang dikembangkan oleh Dalton sendiri.
- Senyawa tertentu selalu mengandung perbandingan massa unsur yang sama.
- Bila dua unsur A dan B membentuk sederet senyawa, rasio massa B yang bereaksi dengan sejumlah A dapat direduksi menjadi bilangan bulat sederhana.
Atom Democritos dapat dikatakan sebagai sejenis miniatur materi. Jadi jumlah jenis atom akan sama dengan jumlah materi. Di pihak lain, atom Dalton adalah penyusun materi, dan banyak senyawa dapat dibentuk oleh sejumlah terbatas atom. Jadi, akan terdapat sejumlah terbatas jenis atom. Teori atom Dalton mensyaratkan proses dua atau lebih atom bergabung membentuk materi. Hal ini merupakan alasan mengapa atom Dalton disebut atom kimia.
Bukti keberadaan atom
Ketika Dalton mengusulkan teori atomnya, teorinya menarik cukup banyak perhatian. Namun, teorinya ini gagal mendapat dukungan penuh. Beberapa pendukung Dalton membuat berbagai usaha penting untuk mempersuasi yang melawan teori ini, tetapi beberapa oposisi masih tetap ada. Kimia saat itu belum cukup membuktikan keberadaan atom dengan percobaan. Jadi teori atom tetap merupakan hipotesis. Lebih lanjut, sains setelah abad ke-18 mengembangkan berbagai percobaan yang membuat banyak saintis menjadi skeptis pada hipotesis atom. Misalnya, kimiawan tenar seperti Sir Humphry Davy (1778-1829) dan Michael Faraday (1791-1867), keduanya dari Inggris, keduanya ragu pada teori atom.
Sementara teori atom masih tetap hipotesis, berbagai kemajuan besar dibuta di berbagai bidang sains. Salah satunya adalah kemunculan termodinamika yang cepat di abad 19. Kimia struktural saat itu yang direpresentasikan oleh teori atom hanyalah masalah akademik dengan sedikit kemungkinan aplikasi praktis. Tetapi termodinamika yang diturunkan dari isu praktis seperti efisiensi mesin uap nampak lebih penting. Ada kontroversi yang sangat tajam antara atomis dengan yang mendukung termodinamika. Debat antara fisikawan Austria Ludwig Boltzmann (1844-1906) dan kimiawan Jerman Friedrich Wilhelm Ostwald (1853-1932) dengan fisikawan Austria Ernst Mach (1838-1916) pantas dicatat. Debat ini berakibat buruk, Boltzmann bunuh diri.
Di awal abad 20, terdapat perubahan besar dalam minat sains. Sederet penemuan penting, termasuk keradioaktifan, menimbulkan minat pada sifat atom, dan lebih umum, sains struktural. Bahwa atom ada secara percobaan dikonfirmasi dengan percobaan kesetimbangan sedimentasi oleh Perrin.
Botanis Inggris, Robert Brown (1773-1858) menemukan gerak takberaturan partikel koloid dan gerakan ini disebut dengan gerak Brow, untuk menghormatinya. Fisikawan Swiss Albert Einstein (1879-1955) mengembangkan teori gerak yang berdasarkan teori atom. Menurut teori ini, gerak Brown dapat diungkapkan dengan persamaan yang memuat bilangan Avogadro.
D =(RT/N).(1/6παη) (1.1)
D adalah gerakan partikel, R tetapan gas, T temperatur, N bilangan Avogadro, α jari-jari partikel dan η viskositas larutan.
Inti ide Perrin adalah sebagai berikut. Partikel koloid bergerak secara random dengan gerak Brown dan secara simultan mengendap ke bawah oleh pengaruh gravitasi. Kesetimbangan sedimentasi dihasilkan oleh kesetimbangan dua gerak ini, gerak random dan sedimentasi. Perrin dengan teliti mengamati distribusi partikel koloid, dan dengan bantuan persamaan 1.1 dan datanya, ia mendapatkan bilangan Avogadro. Mengejutkan nilai yang didapatkannya cocok dengan bilangan Avogadro yang diperoleh dengan metoda lain yang berbeda. Kecocokan ini selanjutnya membuktikan kebenaran teori atom yang menjadi dasar teori gerak Brown.
Tidak perlu disebutkan, Perrin tidak dapat mengamati atom secara langsung. Apa yang dapat dilakukan saintis waktu itu, termasuk Perrin, adalah menunjukkan bahwa bilangan Avogadro yang didapatkan dari sejumlah metoda yang berbeda berdasarkan teori atom identik. Dengan kata lain mereka membuktikan teori atom secara tidak langsung dengan konsistensi logis.
Dalam kerangka kimia modern, metodologi seperti ini masih penting. Bahkan sampai hari ini masih tidak mungkin mengamati langsung partikel sekecil atom dengan mata telanjang atau mikroskop optic. Untuk mengamati langsung dengan sinar tampak, ukuran partikelnya harus lebih besar daripada panjang gelombang sinar tampak. Panjang gelombang sinar tampak ada dalam rentang 4,0 x 10-7- 7,0 x10-7 m, yang besarnya 1000 kali lebih besar daripada ukuran atom. Jadi jelas di luar rentang alat optis untuk mengamati atom. Dengan bantuan alat baru seperti mikroskop electron (EM) atau scanning tunneling microscope (STM), ketidakmungkinan ini dapat diatasi. Walaupun prinsip mengamati atom dengan alat ini, berbeda dengan apa yang terlibat dengan mengamati bulan atau bunga, kita dapat mengatakan bahwa kita kini dapat mengamati atom secara langsung.
Langganan:
Postingan (Atom)